2. DIOXINE: Teil 1
Inhalt:
Teil 1:
Teil 2:
Teil 3:
Die Bezeichnung "Dioxine" stammt aus der Nomenklatur für
Heterocyclen nach dem Hantzsch-Widman-Patterson-System und bezeichnet
ein ungesättigtes Sechsringsystem mit zwei Sauerstoffatomen. Der
als extrem gefährlich identifizierte Wirkstoff, um den es bei den
"Dioxinen" geht, ist jedoch insbesondere das 2,3,7,8-p-TCDD (Tetrachlordibenzo-para-Dioxin),
das mit Abstand die höchste Giftigkeit besitzt. Andere, chemisch
ähnliche Wirkstoffe (s. u.) sind jedoch ebenfalls Ultragifte, so daß
sich eingebürgert hat, hier die Bezeichnungen "Substanzklasse des
Dioxintypus" oder einfach "Dioxine" zu verwenden. Charakteristisch
für die Anreicherung in biologischen Systemen ist die Selektionierung
auf etwa 15 Verbindungen, die ausschließlich 2,3,7,8-substituiert
sind und eine hohe chemische Stabilität aufweisen.
Die Allgemeine Formel für Ultragifte vom Dioxintypus
lautet
(mit X, Y = C, O, N, S oder Leerstelle (z.B. Biphenylen)):
Abb. 1: Allgemeine Formel für Ultragifte
vom Dioxintypus
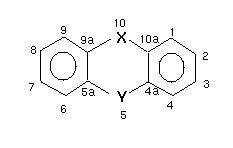
Das Ultragift vom Dioxintypus besitzt eine "kritische
Fläche"
, die 90 - 95 Å beträgt:
Abb. 2: Kritische Fläche dioxinähnlicher Moleküle

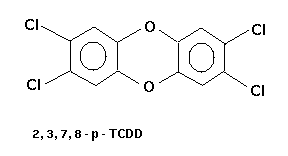
Der giftigste Vertreter innerhalb der Dioxine ist das
2,3,7,8-p-TCDD (2,3,7,8-Tetrachlor-Dibenzo-Para-Dioxin):
Abb. 3: 2,3,7,8-p-TCDD
Einige weitere wichtige Ultragifte vom Dioxin-Typus:
Abb. 4: Ultragifte vom Dioxin-Typus
(Kongenere)
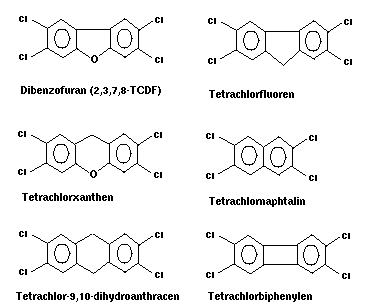
Die ensprechenden Bromderivate sind
von vergleichbarer Toxizität.
2.1.2 Weitere polychlorierte Dibenzo-p-dioxine (PCDD) und Dibenzofurane
(PCDF):
Neben den 2,3,7,8-substituierten Verbindungen existieren weitere
polychlorierte Dibenzo-p-dioxine (PCDD) und Dibenzofurane (PCDF), in
denen die zwei Phenylringe unterschiedlichen Chlorierungsgrad besitzen
können. Für die Chlor-Substitution stehen insgesamt acht Kohlenstoffatome
zur Verfügung (1,2,3,4 und 6,7,8,9; s. Abb.) Es wurden bisher alle
Kongeneren von Mono- bis Octa-Substitution nachgewiesen. Es gibt demnach
genau 75 PCDD-Isomere und 135 PCDF-Isomere, wobei die höhere Anzahl
der PCDF-Chlorhomologen auf eine fehlende Symmetrieebene gegenüber
den PCDD-Chlorhomologen zurückzuführen ist.
Neben diesen rein chlorierten Isomeren gibt es auch die poly-bromierten
Dibenzo-p-dioxine (PBDD) und Dibenzofurane (PBDF), sowie gemischt
chloriert-bromierte Isomere.
Die bromierten Dioxine sind häufig thermische Umwandlungsprodukte
von bromhaltigen Flammschutzmitteln, die in Kunststoffen und
anderen brennbaren Materialien verwendet werden.
Durch die gemischt halogenierten Komponenten erweitert sich die Zahl
der möglichen Dioxin- und Furan-Isomere auf weit über 1000.
Dioxine werden nicht hergestellt, sondern entstehen unbeabsichtigt,
wenn fehlgesteuerte Synthesen, z.B. Herstellung von 2,4,5-T (2,4,5-Trichlorphenoxyessigsäure;
Anwendung z.B. als Entlaubungsmittel im Vietnamkrieg; Codename: "Agent-Orange")
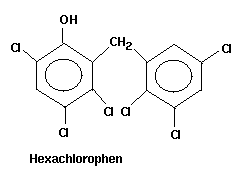
oder Hexachlorophen (zur Hautdesinfektion) ablaufen.
Abb. 5: 2,4,5-Trichlorphenoxyessigsäure
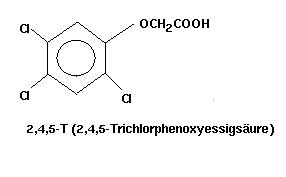
Abb. 6: Hexachlorophen
Generell entstehen Dioxine i.a. bei thermischen Prozessen wie z.B. bei
der Müllverbrennung bzw. bei unkontrollierten Bränden. Höhere
Temperaturen (T > 150 grad C), höhere Drücke (p >
100.000 Pa), alkalische Reaktionsmedien und Anwesenheit von Kupfer und
Kohlenstoff begünstigen die intermolekulare Kondensation passender
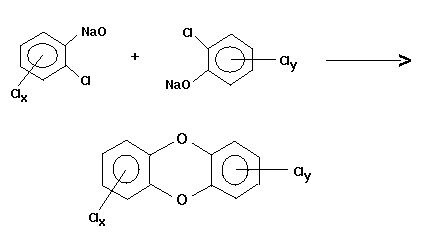
Fragmente zu Dioxinen. Als Beispiel einer "unkontrollierten Reaktion"
mit Dioxin-Bildung sei die intermolekulare Kondensation chlorierter
Phenolate angeführt:
Abb. 7: Intermolekulare Kondensation chlorierter Phenolate
Industrielle Entstehung der Dioxine
Allgemein enstehen Dioxine bei chemischen Prozessen folg. Art
in der angegebenen Prioritätenfolge:
- Prozesse zur Herstellung von Chlorphenolen und Folgeprodukten
- Prozesse zur Herstellung von Chlorbenzolen
- Synthese aliphatischer Chlorverbindungen
- Prozesse mit chlorhaltigen Zwischenprodukten
- Prozesse der anorganischen Chlor-Chemie
- Prozesse unter Verwendung chlorierter Katalysatoren und Solventien
Weiterhin nachgewiesen ist die Bildung von PCDD und PCDF beim
Bleichen von Zellstoff und Papier im ng/kg-Bereich
[75]
sowie bei der Chlorung von Trinkwasser im pg/L-Bereich
[74]
. Im Alltag begegnen Dioxine in Trafokühlmitteln
PCB
, dem Kunststoff PVC oder dem Holzschutzmittel
PCP
. Der Benzinzusatz Dichlorethan (Verhinderung von Bleirückständen)
ist für Dioxine in Autoabgasen verantwortlich.
Die Environmental Protection Agency (EPA) hat eine Liste derjenigen
Stoffe zusammengestellt, bei deren technischer Herstellung mehr als
500 kg/a Dioxine gebildet werden können
[82]
. Die Liste umfaßt vier Untergruppen und enthält 84
organische Chemikalien und 33 Biozide zuzüglich diverser Formulierungen
und Darreichungsformen.
Hervorgehoben seien
Diese Stoffe könen PCDD/F sowohl bei der Herstellung bilden,
als auch in den Endprodukten enthalten. Es wurden z.B. im 2,4,5-Trichlorphenol
bzw. dessen Natriumsalz 2,7-DCDD, 1,3,6,8- und 2,3,7,8-TCDD sowie PeCDD
in ppm-Konzentrationen nachgewiesen. 1863 t Abfälle der 2,4,5-Trichlorphenol-Produktion,
die 1981 durch Seeverbrennung entsorgt wurden enthielten 3,8 kg 2,3,7,8-TCDD
[83]
.
Folg. Mengen PCDD/F wurden in einigen Chemikalien gemessen
[10]
:
Tab. 1: PCDD/F in einigen Chemikalien
___________________________________________________________
Chemikalie gemessene Menge PCDD/F
___________________________________________________________
PCP (Chlophen A 60) ca. 8 ppm (PCDF)
Hexachlorophen ca. 15 ppb (2,3,7,8-TCDD)
Elektrodenschlamm ca. 300 ppb (HpCDF, OCDF u.a.)
___________________________________________________________
Im weitesten Sinne sind alle Verbrennungsprozesse Hauptbildungswege für
PCDD und PCDF. Bei bestimmten Verbrennungsprozessen können unter
geeigneten strukturellen Voraussetzungen (insbesondere unter Beteiligung
von Cl-Donatoren und einem Temperaturbereich von 300 - 600 grad C) hohe
Mengen an toxischen Substanzen wie chlorierte Phenole, Aromaten etc.,
aber auch PCDD und PCDF gebildet werden. Die Thermolyse von 2,4,5-T als
Reinsubstanz im Temperaturbereich von ca. 400 grad C in Anwesenheit von
Sauerstoff führt bsp.weise zur Bildung von bis zu 0,5 % 2,3,7,8-TCDD
[76]
.
In Müllverbrennungsanlagen (MVAs) entstehen Dioxine
bevorzugt in einem mittleren Temperaturbereich
[77, S. 557-584]
. Im Modellexperiment konnte nachgewiesen werden, daß neben
der Dioxin/Furan-Bildung in der Verbrennungszone ein sehr wirksamer
Mechanismus für die Neubildungssynthese auf Flugaschepartikeln in
der Abkühlzone im Bereich von ca. 300 grad C existiert. Verantwortlich
sind hierfür die Restkohlenstoffgehalte sowie KCl und CuCl(2) auf
Flugasche, wobei ein Bildungsoptimum bei ca. 2,25 % C-Gehalt und 2 h Verweilzeit
zu erkennen sind [78]
.
Derzeit existieren 47 MVA-Anlagen in der BRD (Stand: 1994). Es sind weitere
120 Anlagen mit einem Gesamtwerte von 30 - 40 Mrd. DM geplant, darunter
10 Sondermüllverbrennungsanlagen. M. Daunderer
[9, III-3, Müllverbrennungsemissionen S. 1]
beschreibt die Problematik der MVAs folgendermaßen (die
%-Zahlen beziehen sich auf die eingebrachte und anschließend verbrannte
Menge Müll):
1. Die Problematik der Müllverbrennung:
- Es entstehen 25 - 40 % Asche und Flugstaub, 25 % kontaminiertes
Wasser. Die Anlage produziert beim Bau die 6-fache Menge des Eigengewichtes
an Abfall.
- Durch den Bau der MVAs verschwindet der Zwang zur Müllvermeidung,
zum Sortieren und zur Wiederverwertung zum Schutz der Rohstoffe. Bei
Vorselektion gemäß dem Verwertungsgebot nach dem Abfallgesetz
bleibt lediglich der kompostierbare Müll zurück, der nicht verbrannt
werden kann und braucht. Müllverbrennung wäre bei konsequent
betriebener Rohstoff-Schonung und -Wiederverwertung völlig unnötig
und sinnlos!!
- Bei Hochtemperaturverbrennungsanlagen bedeutet das An- und Ausfahren
jeweils einen "Störfall" mit der Folge evt. unkontrollierbarer
Reaktionen, die z.B. vermehrt Dioxine produzieren - trotz Filter- und
Rauchgasanlagen.
- Pro Tonne Müll werden 6000 - 8000 qm Giftgase frei.
- 40 % der staubförmigen Giftstoffe gehen im Umkreis von 5 km
in Windrichtung zur Erde nieder, der Rest breitet sich weiter aus, u.a.
auch in die Stratosphäre.
- Das emittierte Kohlendioxid kann nicht gefiltert werden. Es ruft
eine Erhöhung des Treibhauseffektes, ein Abtauchen der Küstenregionen,
u.a. öko-destruktive Effekte hervor.
- Die bisher 47 MVAs in der BRD (Stand: 1994) emittieren bis zu 12,6
t Cadmium, 378 t Blei, 630 t Zink und 60 t Quecksilber pro Jahr! Diese
gewaltigen Mengen gelangen letztendlich in den Erdboden und das Grundwasser
und damit irgendwann in den menschlichen Organismus. Zitat des Bundesumweltamtes:
"Wenn die bisherige Belastung des Bodens mit Schwermetallen nicht
unverzüglich entscheidend verringert wird, haben wir gute Aussichten,
daß, in 50 Jahren bei uns keine nenneswerte Nahrungsmittelproduktion
mehr stattfinden kann."
- Die Verbrennung des Mülls erhöht dessen Giftigkeit und
Wasser-Löslichkeit. Aus harmlosem Plastik werden u.a. Chlorwasserstoff,
Dioxine u.a.m. freigesetzt bzw. produziert. Es werden Giftstoffe produziert,
die bisher nur zu ca. 20 % bekannt sind. Niemand würde normalerweise
die Verantwortung für unkontrollierte Produktionweisen unbekannter
Giftstoffe, z.B. in einer Chemieanlage, übernehmen.
- Selbst mit heutigen hochmodernen Abgasreinigungs-Verfahren werden
enorme Mengen giftiger bis ultragiftiger Substanzen während der Verbrennung
produziert und freigesetzt. Selbst eine Reduktion der Giftmengen um
99 % durch moderne Müllverbrennungsanlagen gegenüber alten
Anlagen mag auf den ersten Blick eine entscheidende Änderung des Öko-Risikos
von MVAs suggerieren. 1 %, was einer Größenordnung von 1/100
= 10 h(-2) entspricht, ist aber angesichts der Toxicität einiger
Ultragifte in der Größenordnung von ca. 1000 ppb = 10 h(-9)
immer noch sehr viel. Aber selbst wenn MVAs keine Ultragifte mehr produzieren
sollten, bliebe immer noch die unverantwortliche Verschwendung der Umweltresourcen
und die Belastung durch CO(2) (Treibhauseffekt) als kritische Zeitbombe
zurück.
Die jährliche Emission von 2,3,7,8-TCDD aus MVAs in
der BRD kann nur sehr grob abgeschätzt werden und dürfte
ca. 4 kg betragen (Seveso 400 g!) [81]
Letzte Aktualisierung: 12/1995





