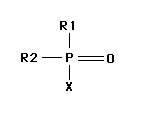
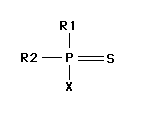
Chemische Grundstruktur der Organophosphate
R1, R2 = Alkyl-, Alkoxy-, Alkylthio-, oder Aminogruppe (meist Methoxygruppe CH3-O-)
X = leicht abspaltbare Gruppe (z. B. -O-CH=CCl3, -O-Ph-p-NO 3)
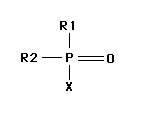
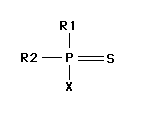
Chemische Grundstruktur der Organophosphate
R1, R2 = Alkyl-, Alkoxy-, Alkylthio-, oder Aminogruppe (meist
Methoxygruppe CH3-O-)
X = leicht abspaltbare Gruppe (z. B. -O-CH=CCl3, -O-Ph-p-NO
3)
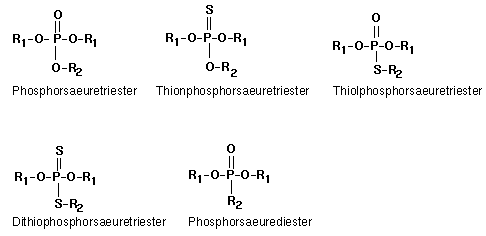
Folgende Substanzklassen der Phosphorsäureester existieren:
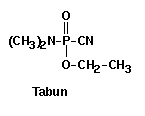
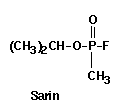
Das Ziel von Schrader war es, Insektizide zu synthetisieren, die für den menschlichen Organismus unschädlich sein sollten. Die Untersuchungen lieferten jedoch Organophosphate, die hochgradig humantoxisch waren und als Nervenkampfstoffe eingesetzt wurden. Ein massgebliches Motiv für die Entwicklung dieser Substanzklasse war also die Verwendung für militärische Zwecke. Aufgrund der Gefährlichkeit dieser Stoffe auch für den menschlichen Organismus entstehen Probleme, die nur sehr schwer zu beherrschen sind. Organische Phosphorsauerester besitzen jedoch gegenüber den anderen Verbindungsklassen große Vorteile:
1. Leichte Hydrolysierbarkeit, damit leichte enzymatische und
abiotische Abbaubarkeit
2. Hohe Toxizität und geringe Aufwandmenge
3. Große Variabilität der Verbindung
4. Größtenteils unproblematische ernährungstoxikologische
Einschätzung.
Der Mechanismus der Nervenimpulsübertragung funktioniert
auf folgende Weise:
die Übertragung der Erregung von einer Nervenzelle zur
anderen oder von der Nervenzelle zur motorischen Endplatte des Muskels
erfolgt nicht elektrisch, sondern chemisch durch Freisetzung von Neurotransmittern.
Die wichtigsten Neurotransmitter sind Acetylcholin und Noradrenalin.
An dieser Stelle soll nur das Acetylcholin interessieren, obwohl die
Primärvorgänge der beiden Neurotransmitter an den Synapsen
weitgehend analog sind.
In den Synapsen wird Acetylcholin nach Eintreffen einer elektrischen Erregung exocytotisch abgeschnürt, indem die synaptischen Vesikel, die den Neurotransmitter enthalten, mit der Membran des Axons verschmelzen, so daß Acetylcholin in den synaptischen Spalt entlassen wird. An der postsynaptischen Membran trifft es auf einen Rezeptor, der eine Spaltöffnung in der postsynaptischen Membran durch lokale Depolarisation auslöst. Die normalerweise Na(+)-undurchläßige Membran wird für einen kurzen Moment durchläesig für Na(+) und löst ein entsprechendes Aktionspotential (z.B. Muskelkontraktion) aus.
Wenn Acetylcholin den Rezeptor erreicht hat, muß es innerhallb kurzer Zeit wieder abgebaut werden, was durch das Enzym Acetylcholin-Esterase (ACE) bewirkt wird. Diese Enzym wird durch die Organophosphorsäureester blockiert, was einer Dauerregung der Postsynaptischen Membran entspricht. Sämtliche organischen Funktionen, allen voran die Herzfunktion, werden außer Kraft gesetzt. Die Grundstruktur der Organophosphate zeichnet sich dadurch aus, daß sowohl basische (Alkoxy-, Alkyl- oder Dialkylamido-Gruppen) als auch saure (Halogen-, Cyanid-, Phenoxy- oder disubstituiertes Pyrophosphat) Substituenten am Phophor gebunden sind. Die Alkanoylgruppen sind als leicht abspaltbare Acylgruppen wichtig für die Reaktionen mit allen serinhaltigen Enzymen (vor allem Acetylcholin-Esterase).
Nach Einlagerung in das aktive Zentrum der ACE spaltet die polare OH-Gruppe im Serinbestandteil des Enzyms normalerweise den Acetylrest des Acetylcholins ab und wird selbst dabei zu Essigsäureserenylester verestert. Die Dauer der Spaltung eines Acetylcholinmoleküls beträgt 40 mcs, die Wechselzahl von ACE beträgt 25000 1/s ! Diese enorm hohe Wechselzahl ist notwendig, damit der Acetylcholinrezeptor wieder neu erregt werden kann. Die Synapsen können bis zu 1000 Impuse pro Sekunde übermitteln, dies ist jedoch nur möglich, wenn die Regenerationszeit der Rezeptoren einen Bruchteil einer Millisekunde beträgt.
Zur Aufrechterhaltung des normalen Muskeltonus wird an den synaptischen Spalten der Muskeln ständig Acetylcholin freigesetzt und sofort von der ACE gespalten (s. Abb.). Das Acetylcholin reagiert mit dem Serin-Rest am aktiven Zentrum des ACE-Enzyms. Bei der Reaktion entsteht eine Acylzwischenverbindung (1), die sehr schnell zu Säure und Alkohol hydrolysiert wird (2). Das anionische Zentrum, das das positiv geladene Stickstoffatom des Acetylcholins bindet, ist die negativ geladene Carboxylgruppe der Aminosäure Glutamin bzw. Asparagin.
Bei Anwesenheit von Organophosphaten aber geht der Phosphatrest nach Abspaltung des Substituenten "X" eine noch instabile Esterbindung mit dem Serin-OH des ACE-Enzyms ein. Nach Abspaltung eines weiteren R1- oder R2-Substituenten geht der monosubstituierte Phosphorsäurerest eine stabile Bindung mit dem Enzym ein ("Alterung"). Damit ist das Enzym nahezu irreversibel gehemmt. Acetylcholin reichert sich an den Rezeptoren an und setzt die sensibel gesteuerte Nervenimpulsübertragung außer Kraft.
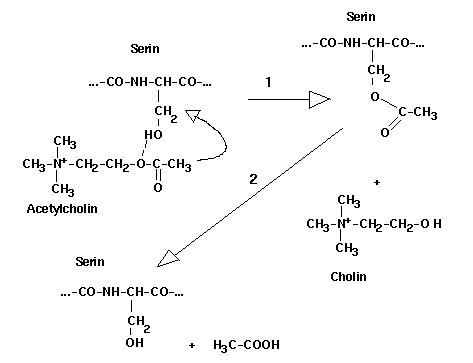
Während die Halbwertszeit der Zwischenverbindung der ACE mit dem Acetylcholin im Millisekundenbereich liegt, ist sie bei der Reaktion mit Alkylphosphaten in der Größenordnung von Tagen anzusetzen. Die ACE ist irreversibel inaktiviert und muß daher durch Neusynthese ersetzt werden.
Die toxische Wirkung der Organophosphate hängt von der Lipophilität, ihrer Affinität zur ACE und von der Hydrolysierbarkeit der aciden Esterkomponente ab.
______________________________________________________________________________________Die biologische Wirkung beruht vorwiegend auf der Hemmung der Acetylcholinesterase und führt zur Akkumulation derselben im postsynaptischen Spalt.
Substanz LD(50) (Ratte, or.) NOEL ADI
[mg/kg] [mg/kg KG] [mg/kg KG/d]
______________________________________________________________________________________
1. Phosphorsäuretriester
-Dichlorvos (DDVP) 62,0 0,033 0,004
{O,O-Dimethyl-O-(2,2-dichlor-
vinyl)-phosphorsäureester)}
-Mevinphos 3,7 0,025 0,015
{O,O-Dimethyl-O-[1-carboxy-
methoxy-prop-1-en-2-yl)-
phophonsäureester}
2. Thionphosphorsäuretriester
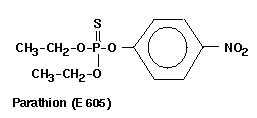
-Parathion (E605) 6,4 0,050 0,005
{O,O-Diethyl-O-(p-nitrophenyl)-
thionphosphorsäureester)}
-Parathion-methyl 15-20 0,100 0,001
-Phoxim 1845 -- --
{O,O-Diethyl-O-(a-cyanbenzyl-
iden-a-amino)-thionphosphor-
säureester}
3. Thiolphosphorsäuretriester
-Demeton-S-methyl 1,7 -- 0,005
(Metasystox)
{O,O-Dimethyl-S-(2-ethylmer-
capto-ethyl)-thiolphosphorsäu-
reester}
4. Dithiophosphorsäuretriester
-Malathion 1200 1,250 0,020
{O,O-Dimethyl-S-(1,2-dicarb-
ethoxyethyl)-dithiophosphor-
säureester
-Dimethoat 250 -- 0,020
{O,O-Dimethyl-S-(N-methyl-
carbamoylmethyl)-dithiophos-
phorsäureester}
5. Phosphorsäurediester
-Trichlorphon 630 -- 0,010
{O,O-Dimethyl-(2,2,2-trichlor-
1-hydroxy)-ethan-phosphon-
säureester}
______________________________________________________________________________________
Als biotransformierende Reaktionen treten in der ersten Phase Oxydationen, Hydrolysen, Reduktionen, Isomerisierung, Desalkylierung und Abbau der Carboxylgruppe auf. Als Zweite Phase treten Konjugationen mit Sulfat bzw. Glucuronsäure in Erscheinung.
Erläuterungen zu den Substanzklassen:
1. Phosphorsäuretriester:
Kontakt-, Fraß- und Atemgifte mit geringer Warmblütertoxizität.
Dichlorvos findet neben dem Einsatz als Sprühmittel auch in Form
von "Strips" im Haushalt Anwendung. Auch höhere Dampfkonzentrationen
führen zu keiner Beeinträchtigung der Cholinesteraseaktivität
beim Menschen. Wegen seiner geringen Beständigkeit entstehen bei
sachgemäßer Behandlung keine Rückstandsprobleme.
Mevinphos ist ein systemisches Insekticid und Akaricid, das durch
seine hohe Inhibitoraktivität gekennzeichnet ist. Aufgrund seiner geringen
Hydrolysebeständigkeit ist es nach Angaben der Hersteller rückstandstoxikologisch
ohne Bedeutung.
2. Thionphosphorsäuretriester:
In diese Gruppe gehören die von Schrader 1944 entdeckten
Gifte Parathion (E 605) und das Methylanalogon Parathion-Methyl
. Die Verbindungen zeigen eine sehr hohe Warmblütertoxizität.
Durch Variation der Substituenten am Phenylring enstehen weniger toxische
Insektizide.
3. Thiolphosphorsäuretriester:
Der wichtigste Vertreter dieser Stoffklasse ist das Demeton-S-methyl
(Metasystox). Die Thiolform des Gemisches ist die für die
systemische Wirkung verantwortliche toxische Komponente. Die Biotransformation
verläuft über de Oxiidation des Sulfidschwefels zu Sulfoxid
und Sulfon, die beide ebenfalls Wirkstoffe darstellen.
4. Dithiophosphorsäuretriester:
Wichtigster Vertreter ist das Malathion und das
Dimethoat , die eine gute akaricide Wirkung zeigen. Malathion
hat nur geringe Warmblütertoxicität und wird als Mittel gegen
Säugetierschädlinge in der Landwirtschaft gegen Hausfliegen,
Läuse und Mücken eingesetzt. In Kombination mit anderen phosphororganischen
Verbindungen soll es potenzierende Wirkung zeigen. Malathion ist auch
ein häufig eingesetzter Wikstoff gegen die Anophelesmücke. Bei
Einhaltung der Karenzzeit entstehen nach Angaben der Hersteller keine Rückstandsprobleme.
5. Phosphorsäurediester:
Werden neben ihrem Einsatz als Kontakt- und Fraßgifte
auch zur Bekämpfung von Ektoparasiten (Parasiten, die auf der Körperoberfläche
nisten) eingesetzt. Das Rückstandsverhalten von Trichlorphon
und Butonat ist gut untersucht. Bei sachgemäßer
Anwendung und der Einhaltung der Karenzzeit entstehen nach Angaben der
Hersteller keine diesbezüglichen Probleme.
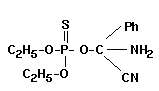
Wird erst seit kurzer Zeit im Holtschutz eingesetzt. Besitzt breites Wirkungsspektrum und weist eine hohe Flüchtigkeit auf.
rel. Molekülmasse: 284,0
Schmelzpunkt [ grad C]: ?
Siedepunkt [ grad C]: ?
Dampfdruck (bei 20 grad C) [hPa]: ?
_________________________________MIK 0,03 mg/cbm
MAK nicht festgesetzt
Spitzenbegrenzung: --
_________________________________
Extrem giftiges Fraß-, Kontakt- und Atemgift. Äußerst flüchtig. Der festgesetzte MIK-Wert beträgt nur 1/6 des entsprechenden PCP-Wertes und dürfte in Wirklichkeit bei weitem übertroffen werden.
rel. Molekülmasse: 291,26
Schmelzpunkt [ grad C]: 6,1
Siedepunkt [ grad C]: 375,0
Dampfdruck (bei 20 grad C) [hPa]: 7,6 x 10(-3)
____________________________________________________________________________________
Wirkstoff [mL/cbm] [mg/cbm] Bemerkungen
____________________________________________________________________________________
Parathion- -- 0,1 G H
Methyl
____________________________________________________________________________________
Spitzenbegrenzung: --
____________________________________________________________________________________
MIK 0,02 mg/cbm
BAT ____________________________________________________________________________ Wirkstoff Wert Untersuchungs- Probennahme- material zeitpunkt ____________________________________________________________________________ Parathion-Methyl 500 mcg/L Ha c) Er c) (als Parameter dient p-Nitrophenol plus Acetylcholinesterase) ____________________________________________________________________________ Weitere Werte: _____________________________________________________________________________________ Wirkstoff LD(50) NOEL ADI [mg/kg] [mg/kg KG] [mg/kg KG/d] _____________________________________________________________________________________ Parathion-Methyl 15-20 0,10 0,001 Parathion-Ethyl 6,4 0,05 0,005 _____________________________________________________________________________________